Contenuto
- stadi
- Metodo 1 Bilanciamento di un'equazione con il metodo di prova ed errore
- Metodo 2 Equilibrare un'equazione con il metodo algebrico
In chimica, un'equazione stabilisce cosa è successo durante una reazione chimica. A sinistra dell'equazione, posizioniamo i reagenti utilizzati per l'esperimento e, a destra, i prodotti ottenuti durante l'esperimento. Secondo il principio di conservazione della massa (Lavoisier) durante una reazione chimica, nessun atomo scompare, nessuno viene creato, si combinano in modo diverso. In breve, è necessario avere lo stesso numero di datomi di ciascun elemento a destra come a sinistra dell'equazione. Ecco perché un'equazione di equilibrio deve essere sempre bilanciata.
stadi
Metodo 1 Bilanciamento di un'equazione con il metodo di prova ed errore
-
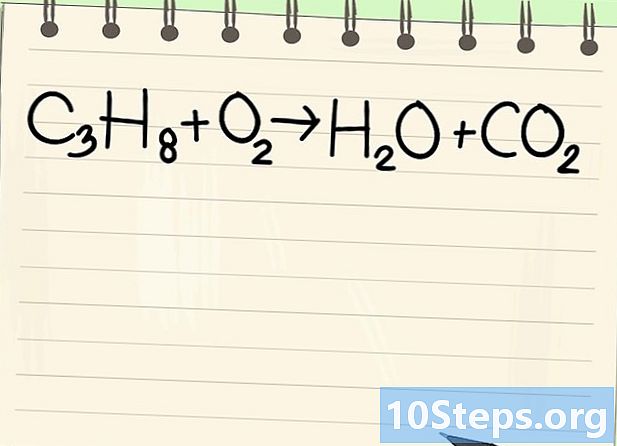
Nota l'equazione del saldo. Tratteremo la seguente equazione:- C3H8 + O2 -> H2O + CO2
- Questa è l'equazione della combustione del propano (C3H8) in ossigeno: si ottengono acqua e anidride carbonica.
-
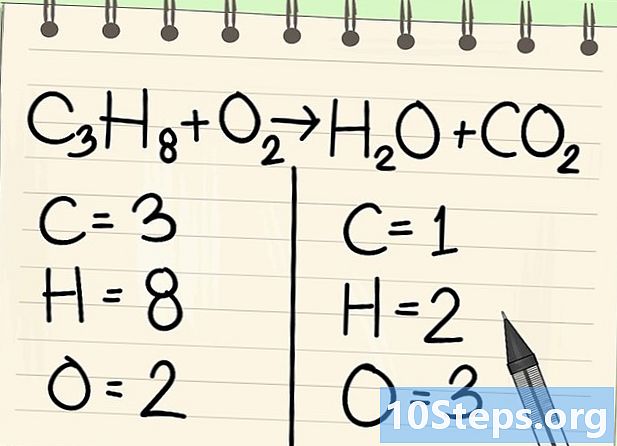
Conta gli atomi. Immettere il numero di datom di ciascun elemento su un lato dell'equazione, quindi sull'altro. Per questo, prendere in considerazione gli indici, se non ce ne sono, l'indice è 1.- A sinistra, ci sono 3 atomi di carbonio, 8 idrogeno e 2 ossigeno.
- A destra, c'è 1 atomo di carbonio, 2 di idrogeno e 3 di ossigeno.
-
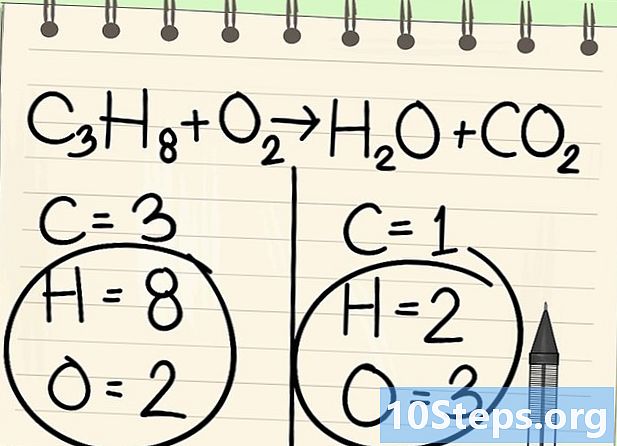
Lasciare momentaneamente da parte l'idrogeno e l'ossigeno. -

Inizia a bilanciare con l'elemento giusto. Iniziamo sempre con quello di una molecola prima e dopo la reazione. Se ce ne sono diversi, prendi quello che è monovalente in una delle molecole. Qui iniziamo con gli atomi di carbonio. -

Equilibrare gli atomi di carbonio. Aggiungere, a destra, un coefficiente alla molecola di biossido di carbonio (CO2) in cui il latome di carbonio è solo. Metteremo un 3 per ottenere i 3 atomi di sinistra.- C3H8 + O2 -> H2O + 3CO2
- Abbiamo quindi 3 atomi di carbonio sulla destra grazie al coefficiente (3CO2) e 3 atomi di carbonio sulla sinistra grazie all'indice (C3H8).
- In un'equazione, puoi mettere tutti i coefficienti che desideri, ma non puoi toccare gli indizi.
-
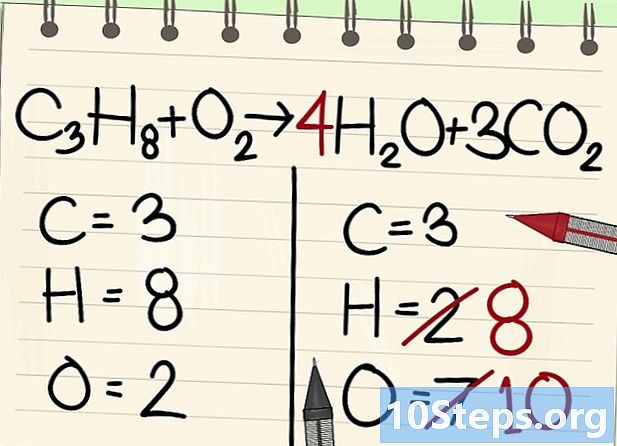
Equilibrare gli atomi di idrogeno. Dato che ne rimangono 8 a sinistra dell'equazione, è necessario altrettanto a destra.- C3H8 + O2 --> 4H2O + 3CO2
- A destra, metterai un coefficiente di 4, perché l'idrogeno è bivalente nella molecola d'acqua: l'indice 2 indica che sono associati due atomi di idrogeno.
- Per ottenere il numero di atomi di idrogeno sulla destra, si moltiplica il coefficiente 4 per l'indice 2 o 8 atomi.
- Per quanto riguarda gli atomi di ossigeno, a destra, ora ce ne sono 6 su un lato, provenienti dalle tre molecole di 3CO2 (3 x 2 = 6 atomi) e 4 dalle 4 molecole di 4 H2O (4 x 1 = 4 atomi), cioè un totale di 10 atomi di ossigeno.
-
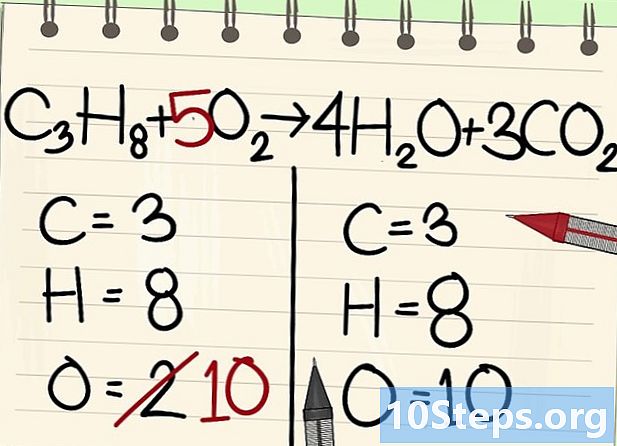
Bilancia gli atomi di ossigeno.- A causa del bilancio del carbonio e dell'idrogeno, il numero di atomi di ossigeno non è lo stesso su entrambi i lati dell'equazione. Abbiamo visto in precedenza che c'erano 10 atomi di ossigeno sulla destra (4 da molecole di acqua e 6 da molecole di biossido di carbonio). A sinistra, ci sono solo 2 (da O2).
- Per bilanciare l'ossigeno, aggiungi un coefficiente di 5 alla molecola di ossigeno sinistra: hai 10 atomi di ossigeno a sinistra e l'altro a destra.
- C3H8 + 5O2 -> 4H2O + 3CO2
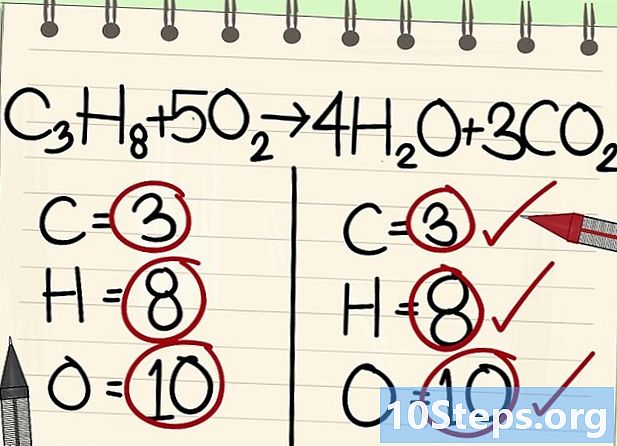
- Tutti gli atomi (carbonio, idrogeno e ossigeno) sono bilanciati: l'equazione è bilanciata.
Metodo 2 Equilibrare un'equazione con il metodo algebrico
-

Scrivi l'equazione per bilanciare. Assegna a ciascuna molecola un coefficiente letterale. Li chiameremo ha, B, c e d. -
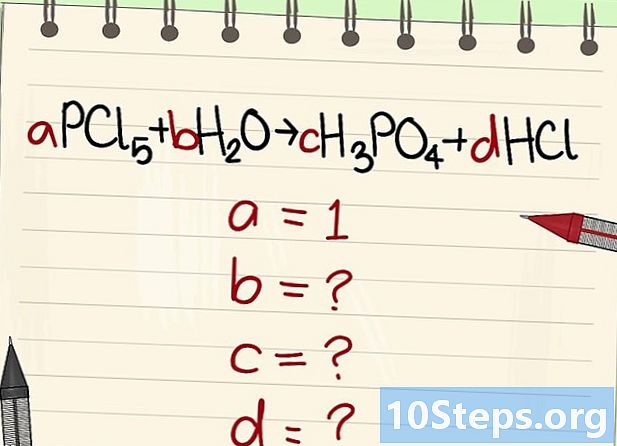
Trova il valore degli altri coefficienti letterali. Lo chiederemo ha = 1. -

Trova le relazioni tra questi coefficienti. Guardando a sinistra (reagenti) e a destra (prodotti), stabilire le relazioni tra questi diversi coefficienti.- Prendi la seguente equazione: aPCl5 + bH2O = cH3PO4 + dHCl. È stato affermato che a = 1, il che significa che c = a, d = 5a e 2b = 3c + d. Calcoli eseguiti, c = 1, d = 5 e b = 4.

- Prendi la seguente equazione: aPCl5 + bH2O = cH3PO4 + dHCl. È stato affermato che a = 1, il che significa che c = a, d = 5a e 2b = 3c + d. Calcoli eseguiti, c = 1, d = 5 e b = 4.