Contenuto
Altre sezioniGli atomi sono i mattoni di tutta la materia. Diversi tipi di atomi sono indicati come "elementi" e vengono compilati in un grafico chiamato tavola periodica. La tabella consente di raggruppare elementi simili in base alle loro proprietà chimiche. È interessante notare che gli atomi dello stesso gruppo hanno spesso anche proprietà fisiche simili. Se vuoi acquisire una comprensione delle proprietà chimiche e fisiche degli atomi, impara a dividere la tavola periodica in gruppi e studia le proprietà di ciascun gruppo.
Passi
Metodo 1 di 3: divisione della tavola periodica
Individua gli elementi non metallici. Nella tavola periodica, la maggior parte degli atomi è classificata come metalli. Altri atomi sono classificati come non metalli. Troverai questi raggruppamenti utili mentre esplori le proprietà di diversi atomi.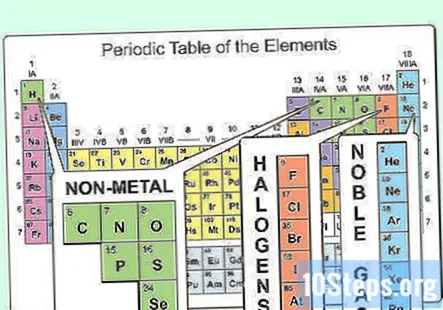
- I non metalli possono essere trovati principalmente nell'angolo in alto a destra della tavola periodica, mentre il resto della tavola è costituito principalmente da metalli. L'idrogeno è un'eccezione a questa regola, in quanto si comporta come un non metallo in condizioni standard, ma si trova nell'angolo in alto a sinistra della tabella.
- Carbonio, azoto, ossigeno, idrogeno, zolfo e gas nobili (gli elementi nella colonna più a destra) sono comunemente noti non metalli.
- Gli alogeni (come fluoro, cloro, bromo, ecc.) Rientrano nella categoria dei non metallici.

Differenzia i principali raggruppamenti di metalli. I metalli sono raggruppati in sottocategorie. Gli elementi all'interno di queste sottocategorie sono simili in modi più specifici rispetto alla semplice identificazione di entrambi come metalli. Le categorie comuni sono metalli alcalini, metalli alcalino terrosi, metalli di transizione, metalli di post-transizione, lantanidi e attinidi.- I metalli alcalini sono molto reattivi e si ionizzano prontamente a uno stato.
- I metalli alcalino terrosi sono leggermente meno reattivi, ma ionizzano prontamente a uno stato 2.
- I metalli di transizione e post transizione sono più stabili e hanno molti stati di ionizzazione diversi.
- I lantanidi e gli attinidi sono molecole più grandi e meno stabili che reagiscono prontamente. Alcuni di loro si decompongono, rendendoli radioattivi.

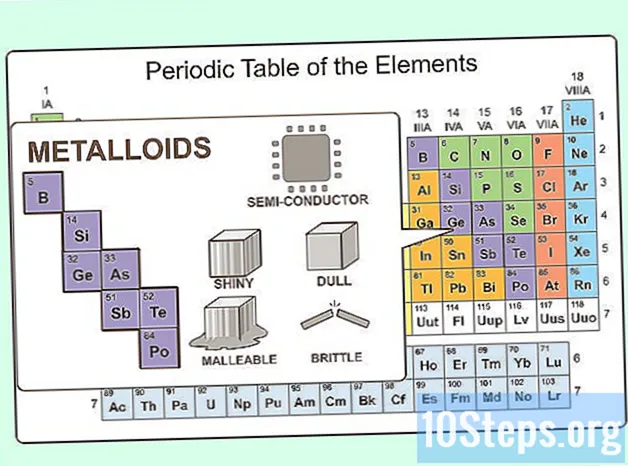
Immagina qualcosa tra un metallo e un non metallo. Tali elementi esistono e sono noti come metalloidi. Nella tavola periodica, i metalloidi compaiono tra metalli post-transizione e non metalli. Esistono otto metalloidi:- Boro
- Silicio
- Germanio
- Arsenico
- Antimonio
- Tellurio
- Polonio
- Astato
Metodo 2 di 3: analisi delle caratteristiche chimiche

Guarda l'ordine del tavolo. Quando guardi la tavola periodica, noterai che gli elementi sono tutti numerati. Questa numerazione è tutt'altro che casuale. In realtà, è noto come numero atomico per quel particolare elemento ed è uguale al numero di protoni che l'elemento ha nel suo nucleo.- Per gli atomi (non gli ioni), il numero atomico rappresenta anche il numero di elettroni nell'atomo. Il numero di protoni ed elettroni in un atomo è uguale.
- Su alcune tabelle periodiche, noterai un secondo numero che è in un carattere più piccolo. Questa è la massa atomica media per quell'elemento.
Visualizza gli elettroni di valenza. Gli elettroni di valenza sono gli elettroni nel guscio più esterno della nuvola di elettroni di un atomo. Gli elettroni di valenza sono il singolo fattore più importante nel modo in cui l'atomo reagirà chimicamente. La configurazione più stabile per un atomo è quella di avere gli elettroni nel suo guscio esterno riempito, quindi non si legherà con altri atomi. Nella maggior parte dei casi, il guscio esterno deve contenere otto elettroni per essere pieno (a seconda delle dimensioni dell'atomo questo può variare).
- Ad esempio, il fluoro ha nove elettroni. I primi due riempiono l'orbitale più interno, i restanti sette sono elettroni di valenza. Ciò significa che il fluoro ha bisogno solo di un altro elettrone per riempire il suo guscio di valenza. Pertanto, il fluoro reagisce prontamente con gli atomi che possono cedere un elettrone (in particolare i metalli).
- Un esempio del contrario è il litio. Il litio ha tre elettroni. I primi due riempiono il guscio più interno e l'ultimo è un elettrone di valenza. Poiché il litio avrebbe bisogno di guadagnare sette elettroni per riempire il suo guscio di valenza, è più facile (più energeticamente favorevole) per lui liberarsi dell'unico elettrone di valenza che ha. Quindi, il litio reagisce prontamente con elementi che accetteranno un elettrone (come gli alogeni).
Considera la dimensione dell'atomo. Sebbene gli elettroni di valenza siano il miglior predittore delle proprietà chimiche in un dato atomo, anche la dimensione dell'atomo è importante. Gli atomi più grandi hanno più elettroni tra il nucleo e gli elettroni di valenza, il che significa che sono tenuti all'atomo in modo più lasco rispetto agli atomi più piccoli. Questo spiega perché due atomi con lo stesso numero di elettroni di valenza (ad esempio, fluoro e cloro) hanno proprietà chimiche simili, ma non identiche.
Impara le tendenze della tavola periodica. Conoscere le tendenze periodiche può aiutarti a riconoscere le probabili proprietà chimiche di un elemento in base alla sua posizione nella tavola periodica. È importante, tuttavia, ricordare che tre gruppi (gas nobili, lantanidi e attinidi) non seguono queste tendenze a causa della loro chimica unica. Alcuni trend periodici sono:
- La massa atomica aumenta da sinistra a destra e dall'alto verso il basso.
- Il raggio atomico diminuisce da sinistra a destra e aumenta dall'alto verso il basso.
- L'elettronegatività aumenta da sinistra a destra e diminuisce dall'alto verso il basso.
- L'energia di ionizzazione aumenta da sinistra a destra e diminuisce dall'alto verso il basso.
- L'affinità elettronica aumenta da sinistra a destra e diminuisce dall'alto verso il basso.
- Il carattere metallico diminuisce da sinistra a destra e aumenta dall'alto verso il basso.
Metodo 3 di 3: esame degli attributi fisici
Identifica le proprietà non metalliche. I non metalli esistono in tre stati fisici a temperatura ambiente (solido, liquido e gas), ma sono principalmente gas a temperatura ambiente. I metalli non metallici sono generalmente opachi e fragili quando sono solidi e tipicamente si sciolgono e bollono a temperature inferiori rispetto ai metalli. I metalli non metallici sono anche cattivi conduttori di calore ed elettricità.
- L'unico materiale non metallico che è un liquido a temperatura ambiente è il bromo.
- Il carbonio ha il punto di fusione più alto di tutti gli elementi.
Conosci le proprietà fisiche dei metalli. I metalli sono lucidi e malleabili. Conducono bene anche il calore e l'elettricità. I metalli sono per lo più solidi a temperatura ambiente, sebbene il mercurio sia un liquido. I metalli hanno generalmente punti di fusione e di ebollizione elevati rispetto ai non metalli.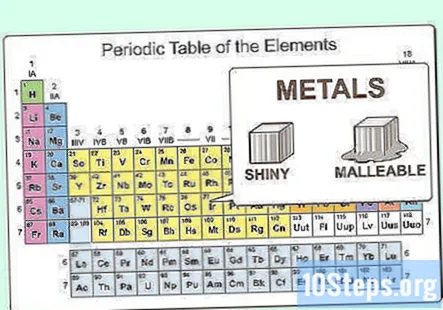
Nota i gas nobili. Gli elementi che compongono la colonna più a destra sono noti come gas nobili. Sono chimicamente inerti e si trovano tutti in fase gassosa a temperatura ambiente. Questi gas sono usati per cose come riempire palloncini e insegne luminose.
Considera i metalloidi. Proprio come i metalloidi possiedono proprietà chimiche sia dei metalli che dei non metalli, possiedono proprietà fisiche di entrambi. Sono semiconduttori. Possono essere malleabili o fragili. Possono anche essere lucidi o opachi.
Domande e risposte della comunità
L'elettronegatività non dovrebbe aumentare un gruppo?

La ricercatrice scientifica Meredith Juncker è una dottoranda in Biochimica e Biologia Molecolare presso il Centro di scienze della salute della Louisiana State University. I suoi studi si concentrano sulle proteine e sulle malattie neurodegenerative.

Suggerimenti
- Puoi creare biglietti per studiare diversi gruppi di elementi.
- Se ti è permesso usare una tavola periodica su esami e test, puoi usarla per aiutarti a trovare molte delle risposte.
Avvertenze
- Ci sono molte informazioni contenute nella tavola periodica. Prenditi il tuo tempo e studia ogni giorno invece di cercare di trattenerlo in una sola sessione di lavoro.


